Сначала апреля 2012 года представители Южноамериканского общества генных и клеточных терапевтов (ASGCT) на общественном заседании выступили с предложением об отмене надзора Совещательного комитета по рекомбинантной ДНК (RAC) за тестами и клиническими испытаниями в области генной терапии.
И в то же время согласился с тем, что RAC должен пойти на компромисс, и, может быть, урезать свои возможности.
Геннотерапевтические препараты, в базе деяния которых лежит принцип временного введения в клеточки организма пациента функциональных генов, сегодня считаются одним из самых перспективных направлений в медицине.
Артур Исаев, директор российского Института Стволовых Клеток Человека (ИСКЧ) считает, что: «Американцы заговорили об ослаблении жестких требований в области создания геннотерапевтических препаратов сначала так как ученые и разработчики других стран стали опережать США во внедрении генной терапии в клиническую практику».
В Китае с 2003 года официально разрешены и применяются в клинической практике два геннотерапевтических препарата – Гендицин и H101, созданные для лечения тяжелых форм рака шеи и головы.Эми Патерсон (Amy Patterson), директор Ассоциации по научной политике (NIH) отметила, что инициатива ASGCT никак не связана с планами ликвидации RAC. «Мы считаем, что принципиально иметь площадку для свободной дискуссии… и рады помыслить о путях рационализации действий RAC».
Юман Фонг (Yuman Fong), председатель RAC, в ответ на инициативу ASGCT призвал к осторожности: «Уход от проверки огромного количества причин к полному отсутствию проверки — это большой шаг». Он также отметил, что пока ни одна методика генной терапии не утверждена FDA для использования в медицинской практике.
По воззрению большинства членов ASGCT «настало время пересмотреть возможности RAC», сделанного в 1974 году, сначала так как все материалы по экспериментальным методикам в области генной терапии, присланные в RAC, в неотклонимом порядке также рассматриваются FDA и основными комитетами по этике и биобезопасности.
Ксандра Брейкфилд (Xandra Breakefield), новый президент ASGCT считает, что «основные задачи био безопасности в реальный момент не касаются исследовательских работ в области генной терапии.
Опаски, что в итоге генноинженерных тестов будет сотворен новый патогенный вектор либо будет изменена ДНК людского зародыша, не оправдались».
Причина первенства Китая в этом вопросе связана именно с тем, что получить разрешение на проведение клинических испытаний в КНР значительно легче, чем в США и Европе.
7 декабря 2011 года Институт Стволовых Клеток Человека получил регистрационное удостоверение на геннотерапевтический препарат Неоваскулген®, созданный для лечения хронической ишемии нижних конечностей (ХИНК), включая критическую (КИНК). Решение о включении препарата в государственный реестр лекарственных средств для медицинского применения было принято Министерством здравоохранения и социального развития (МЗСР) РФ на основании выводов о его эффективности и безопасности по результатам проведенных ИСКЧ доклинических и клинических исследований.
Начало продаж Неоваскулгена® на территории РФ запланировано на 2 квартал 2012 года.
Медицина 2.0 (www.med2.ru)
Читайте также:
 В Росздравнадзоре обсудят проблемы пациентов
В Росздравнадзоре обсудят проблемы пациентов24-01-2013
Федеральная служба по надзору в сфере здравоохранения и общественного развития информирует, что 17...
 Обнаружены «гены молодости», характерные только для женщин
Обнаружены «гены молодости», характерные только для женщин10-12-2012
Дамы владеют уникальным набором генов, позволяющих им противостоять старению.В теории при помощи...
 Борьба с ожирением приводит к анорексии
Борьба с ожирением приводит к анорексии15-08-2013
Это подтверждает случай 31-летней жительницы Кирьят-Малахи Тамар Майи Браунер, передает "NEWSru...
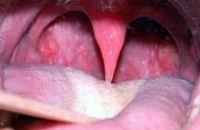 Врачи предлагают бороться с храпом, отрезав часть языка
Врачи предлагают бороться с храпом, отрезав часть языка25-01-2013
Приблизительно 40% человек мучаются от храпа. 10% из их имеют апноэ сна. Врачи выдумали, как...
 Одни из самых популярных БАДов оказались бесполезными
Одни из самых популярных БАДов оказались бесполезными25-01-2013
Миллионы человек принимают БАДы с рыбьи жиром, надеясь, тем, защитить свое сердечко. Правда, в...









 Приближение ответственного события часто сопровождается проблемами со сном. Чем активнее попытки заставить себя ...
Приближение ответственного события часто сопровождается проблемами со сном. Чем активнее попытки заставить себя ...
 Когда кофе бодрит, а когда истощает. Всё о влиянии кофеина на мозг. Как он работает, где проходит грань пользы и вреда, ...
Когда кофе бодрит, а когда истощает. Всё о влиянии кофеина на мозг. Как он работает, где проходит грань пользы и вреда, ...
 Что делать, если препараты железа вызывают запор. Рассказываем про современные мягкие альтернативы и как лечить ...
Что делать, если препараты железа вызывают запор. Рассказываем про современные мягкие альтернативы и как лечить ...
 Практически каждый специалист предпочитает Стоматологические установки купить, которая бы полностью удовлетворяла ...
Практически каждый специалист предпочитает Стоматологические установки купить, которая бы полностью удовлетворяла ...