Лебрикизумаб может стать первым продуктам для персонализированной терапии астмы.
Лебрикизумаб — это гуманизированное моноклональное антитело, разработанное Genentech Research и Early Development и проходящее исследование у пациентов с неконтролируемым течением астмы.
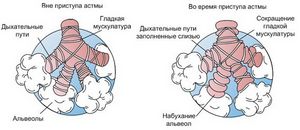
Лебрикизумаб перекрывает цитокин ИЛ-13 (белок, регулирующий взаимодействие меж клеточками) и понижает выраженность воспаления слизистой оболочки бронхов.
Об исследовании II фазы (MILLY)
Исследование MILLY ( a global phase II randoMized, double blInd, placebo-controLled study to evaLuate the safetY, tolerability and efficacy of lebrikizumab in adult patients with asthma who are inadequately controlled on inhaled corticosteroids) – это многоцентровое рандомизированное, двойное слепое, плацебо-контролируемое исследование II фазы (спонсоры «Рош»/Genentech) для оценки безопасности, переносимости и эффективности внедрения лебрикизумаба у взрослых пациентов с неадекватным контролем астмы, невзирая на проводимую терапию ингаляционными глюкокортикостероидами, применяемыми для стандартной базовой терапии астмы. Компания была основана в 1896 году в Базеле, Швейцария, и на сегодня имеет представительства в 150 странах мира и штат сотрудников более 80 000 человек.
Инвестиции в исследования и разработки в 2010 году составили более 9 миллиардов швейцарских франков, а объем продаж группы компаний «Рош» составил 47,5 миллиарда швейцарских франков.Исследование также показало имеющуюся тенденцию к уменьшению количества томных приступов астмы (узнаваемых как обострения) у пациентов, получавших лебрикизумаб. Эти результаты обнадеживают, потому что томные приступы астмы представляют потенциальную опасность для жизни.
Лебрикизумаб может принести пользу клиентам с неконтролируемым течением астмы и отсутствием эффекта от проводимой терапии.
О препарате лебрикизумаб
Понятно, что лишная продукция ИЛ-13 приводит к воспалительным изменениям дыхательных путей, соответствующих для астмы.Компания «Рош» (SIX: RO, ROG; OTCQX: RHHBY) объявила о положительных результатах исследования II фазы по исследованию инноваторского продукта лебрикизумаб, гуманизированного моноклонального антитела, разработанного для блокады интерлейкина-13 (ИЛ-13). В процессе исследования исцеление лебрикизумабом привело к статистически важному повышению ОФВ1 (показатель функции легких) у взрослых пациентов с неадекватным контролем астмы, получавших ингаляционные глюкокортикостероиды (ИГКС).
Общая частота ненужных явлений в группе исцеления и группе плацебо была идентичной. Лебрикизумаб вводили подкожно 1 раз в 28 дней в дозе 250 мг, всего 6 инъекций. В исследование было рандомизировано 219 пациентов, один пациент исцеления не получил.
100 6 пациентов были рандомизированы в группу лебрикизумаба, а 112 пациентов — в группу плацебо. Первичной конечной точкой (аспектом эффективности) исследования был показатель функции легких: «объем форсированного выдоха за 1 секунду, измеренный до ингаляции бронходилятаторов (ОФВ1)».*
Первичная конечная точка исследования показала, что на 12-й неделе у пациентов, получавших лебрикизумаб, отмечалось на 5.5% (95%ДИ 0.8-10.2%; P=0.02) больше повышение ОФВ1, измеренного до ингаляции бронходилататоров по сравнению с исходным значением, чем у пациентов, получавших плацебо (лебрикизумаб, 9,8%±1,9%; плацебо, 4,3%±1,5%). У пациентов в группе лебрикизумаба с высоким исходным уровнем периостина наблюдалось относительное увеличение ОФВ1 на 8,2% (P=0,03) от исходного уровня в сравнении с группой плацебо.
У пациентов в группе лебрикизумаба с низким уровнем периостина отмечено относительное увеличение ОФВ1 на 1,6% (P=0,61) от исходного уровня в сравнении с группой плацебо. Периостин измеряли в сыворотке крови, используя количественный метод анализа белков.
Вторичные критерии оценки эффективности включали частоту предусмотренных протоколом обострений и тяжелых обострений (прогрессирование астмы) в протяжении 24 недель исследования.Наиболее частыми нежелательными явлениями были инфекции (лебрикизумаб 48,1%, плацебо 49,1%), включая инфекции верхних дыхательных путей (лебрикизумаб 12,3%, плацебо 14,3%) и придаточных пазух носа (лебрикизумаб 9,4%, плацебо 8,0%). Общая частота нежелательных явлений и серьезных нежелательных явлений не различалась в обеих группах (лебрикизумаб 74,5%, плацебо 78,6% и лебрикизумаб 3,8%, плацебо 5,4%, соответственно).
Нежелательные явления со стороны костно-мышечной системы чаще встречались в группе лебрикизумаба (лебрикизумаб 13,2%, плацебо 5,4%). Хотя исследование не обладало достаточной мощностью для выявления снижения частоты обострений, была отмечена тенденция к уменьшению количества тяжелых обострений у пациентов, получавших терапию лебрикизумабом.
*ОФВ1 — количество воздуха, которое можно с усилием выдохнуть за секунду после глубокого вдоха.
Общая частота нежелательных явлений в группе лечения не отличалась от частоты в группе плацебо.
Серьезные нежелательные явления (СНЯ) наблюдались у 4 пациентов, которые получали лебрикизумаб, из них 2 СНЯ (внебольничная пневмония и травматический пневмоторакс вследствие ДТП) были отмечены у пациентов с приступами астмы.
Двадцать пять пациентов (11,5%) прекратили участие в исследовании досрочно, включая 12 пациентов из группы плацебо и 13 пациентов из группы лебрикизумаба.
О компании Рош
Компания «Рош» входит в число ведущих компаний мира в области фармацевтики и является лидером в области диагностики in vitro и гистологической диагностики онкологических заболеваний.
Стратегия, направленная на развитие персонализированной медицины, позволяет компании «Рош» производить инновационные препараты и современные средства диагностики, которые спасают жизнь пациентам, значительно продлевают и улучшают качество их жизни. Являясь одним из ведущих производителей биотехнологических лекарственных препаратов, направленных на лечение онкологических заболеваний, тяжелых вирусных инфекций, аутоиммунных воспалительных заболеваний, нарушений центральной нервной системы и обмена веществ и пионером в области самоконтроля сахарного диабета, компания уделяет повышенное внимание вопросам сочетания эффективности своих препаратов и средств диагностики с удобством и безопасностью их использования для пациентов.
Результаты этого исследования, известного под заглавием «MILLY», размещены в журнальчике New England Journal of Medicine, NEJM 3 августа 2011 года.
ИЛ-13 является главным фактором в развитии проявлений астмы, также приводит к повышению количества белка периостина в крови..
В этом исследовании у пациентов с высочайшим уровнем периостина до начала исцеления отмечалось более выраженное улучшение функции легких при терапии лебрикизумабом, по сопоставлению с пациентами, у каких уровень периостина был низким.
«Результаты исследования MILLY и поиск вероятного биомаркера астмы показали возможность отбора пациентов, которые с большей вероятностью ответят на исцеление лебрикизумабом»— произнес Ричард Шеллер (Richard Scheller), исполнительный вице-президент компании «Genentech» по исследованиям и ранешным шагам разработки (gRED). «Эти результаты свидетельствуют в пользу предстоящего исследования лебрикизумаба как продукта для персонализированной терапии пациентов с неконтролируемым течением астмы умеренной либо тяжеленной степени».
Компании «Рош» полностью принадлежит компания Genentech, США и контрольный пакет акций компании Chugai Pharmaceutical, Япония. Дополнительную информацию о компании «Рош» в России можно получить на сайте www.roche.ru
Медицина 2.0 (www.med2.ru)
Читайте также:
 Российские хирурги впервые провели успешную трансплантацию легких
Российские хирурги впервые провели успешную трансплантацию легких11-02-2014
В первый раз русские врачи-трансплантологи НИИ им. А удачной ее можно именовать только когда...
 Попкорн опасен для легких
Попкорн опасен для легких15-04-2013
Южноамериканские ученые сделали вывод, что попкорн домашнего изготовления может представлять...
 Странная болезнь ветеранов войны в Ираке
Странная болезнь ветеранов войны в Ираке30-08-2012
Нередкими жалобами боец, вернувшихся после военных действий в Ираке и Афганистане, являются...
 Сконструировано искусственное легкое, не требующее кислорода
Сконструировано искусственное легкое, не требующее кислорода15-04-2013
Исследователи Института Кейс Вестерн Резерв сделали искусственное легкое. Сокращение расстояния,...
 Кашель – междисциплинарная проблема. Взгляд оториноларинголога
Кашель – междисциплинарная проблема. Взгляд оториноларинголога11-02-2014
М.А. С патофизиологической точки зрения, гастроэзофагеальная рефлюксная болезнь (ГЭРБ) является...









 Приближение ответственного события часто сопровождается проблемами со сном. Чем активнее попытки заставить себя ...
Приближение ответственного события часто сопровождается проблемами со сном. Чем активнее попытки заставить себя ...
 Когда кофе бодрит, а когда истощает. Всё о влиянии кофеина на мозг. Как он работает, где проходит грань пользы и вреда, ...
Когда кофе бодрит, а когда истощает. Всё о влиянии кофеина на мозг. Как он работает, где проходит грань пользы и вреда, ...
 Что делать, если препараты железа вызывают запор. Рассказываем про современные мягкие альтернативы и как лечить ...
Что делать, если препараты железа вызывают запор. Рассказываем про современные мягкие альтернативы и как лечить ...
 Практически каждый специалист предпочитает Стоматологические установки купить, которая бы полностью удовлетворяла ...
Практически каждый специалист предпочитает Стоматологические установки купить, которая бы полностью удовлетворяла ...