Для интернациональной фармы быстрорастущий лекарственный рынок Рф и других государств БРИКС представляет большой энтузиазм. Но из страны, которая гордилась тем, что проводит международные клинические исследования (КИ) новейших фармацевтических средств, Наша родина равномерно преобразуется в исследователя дженериков.
Таковой вывод прозвучал на конференции «Исследование и разработка инноваторских препаратов в России», проведенной не так давно Институтом Адама Смита.
Клинические иссследования, а в особенности роль страны в мультицентровых интернациональных исследованих новых препаратов, — это не только лишь признание высочайшей квалификации ее докторов и ученых.Все эти проблемы хорошо известны регулятору, который проявляет заинтересованность в их решении.
Профессиональное сообщество рассчитывает, что это приведет к улучшению администрирования КИ, и Россия подтвердит свой высокий статус на этом рынке.
А именно, норма о том, что сейчас требуется непременное проведение КИ в Рф, чтоб продукт у нас был зарегистрирован.
Большие международные производители, которые приходят к нам с уже готовым новым лекарством и проведенными исследовательскими работами, обязаны проводить КИ дополнительно. Для русских пациентов это выливается в двухгодичное ожидание инноваторских препаратов.
В самом сложном положении оказались орфанные препараты, так как для их проведение КИ более проблематично, потому что есть препядствия с набором пациентов.
Осложняет выход на рынок КИ новых игроков ужесточение требований к исследователю: наличие 5-летнего опыта и определенная специализация; усложненный механизм страхования; необходимость аккредитации клинических центров; запрет I фазы (здоровые добровольцы) для иностранных препаратов и т. д. К плюсам закона об обращении лекарственных средств можно отнести ожидаемый прирост рынка международных многоцентровых клинических исследований (ММКИ), так как спонсоры, дабы избежать повторных исследований, сразу начинают проводить их в России.
За три квартала 2012 года Россия по числу КИ показала самый высокий результат, начиная с 2004 года: проведено 280 ММКИ, 36 локальных КИ иностранных спонсоров, 74 исследования биоэквивалентности иностранных спонсоров и 169 — отечественных спонсоров, 127 КИ российских спонсоров.- Мы считаем эту норму избыточной, тем паче, что в законодательствах других стран аналогов ей нет, — говорит Светлана Завидова. — Представители власти пытаются нас успокоить тем, что результаты КИ будут признаваться Россией в случае заключения двусторонних договоров о взаимном признании. Но это нонсенс: клинические исследования не могут быть предметом международного договора, потому что они относятся к результатам деятельности не государственных органов, а отдельных компаний.
Во всех продвинутых странах критерием признания КИ является их проведение по стандарту GCР.
Однако при всем этом в общем числе исследований доля ММКИ упала почти на 20%, поскольку более быстрыми темпами растет число исследований дженериков.
Так, до принятия ФЗ-61 доля исследований биоэквивалентности иностранных спонсоров составляла 1,8%, а теперь — 11. Налицо тенденция к увеличению исследования дженериков.
Доля же локальных КИ как зарубежных, так и российских спонсоров практически не изменилась, другими словами компании заняли выжидательную позицию и наблюдают за развитием рынка.
Выступая за интересы пациентов, минздрав планирует ввести фармацевтическую экспертизу образцов лекарственных препаратов непосредственно на этапе КИ.
В международной практике такое не встречается, замечает Светлана Завидова.Такая норма применяется исключительно в Китае , но только для биопродуктов, а международных исследований она не касается. Но Китай сегодня занимает предпоследнее место в мире по срокам получения разрешения на КИ.
Если она будет введена у нас, то, учитывая высокую конкуренцию на рынке, Россия просто выпадет из рынка ММКИ.
По мнению исполнительного директора компании Medpase Марка Тулчинского, с 2008 года ситуация ухудшается: число клинических центров упало с 1084 до 864, а их плотность на 1 млн населения России, соответственно, с 7,6 до 6,2.
В этом секторе Россия стоит на последнем месте среди стран Европы и Америки, что говорит о сокращении доступности новейших препаратов для граждан страны. По словам директора по клиническим исследованиям MSD в России, Украине и СНГ Татьяны Серебряковой, практически везде отсутствует эффективная коммуникация со стороны КЦ, несовпадение процедур MSD и КЦ, есть проблемы с подписанием контрактов, набором пациентов.
Среди «частностей» — плохое знание английского языка, небыстрый Интернет. И еще одна, чисто российская черта: пациенты, боясь огорчить доктора, не сообщают ему о негативных эффектах препарата, из-за чего у исследователей возникают проблемы в третьей фазе КИ.
Эксперты считают, что российские клинические центры (КЦ) привлекательны для иностранных спонсоров качеством проводимых исследований. По данным FDA (Администрация США по контролю за продуктами питания и лекарствами), в России самый высокий среди всех стран мира показатель проверок, не выявивших никаких нарушений при проведении КИ.
Все же привлечь зарубежного спонсора трудно из-за административных барьеров и прочих проблем. Скажем, компания MSD сотрудничает с несколькими центрами в России.
Это к тому же способности для пациентов, страдающих томными приобретенными болезнями, получить новые лекарства безвозмездно. Потому страны конкурируют за честь провести их.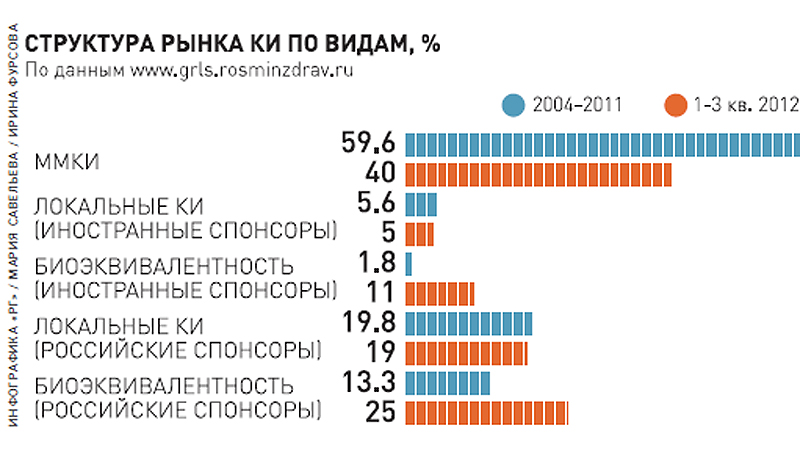
По словам исполнительного директора Ассоциации организаций по клиническим исследованиям (АОКИ) Светланы Завидовой, на рынок КИ оказывает влияние много причин., но главное находится в зависимости от законодательной базы и регулирующих органов. Значительно воздействовал на ситуацию 61-й ФЗ «Об воззвании фармацевтических средств».Медицина 2.0 (www.med2.ru)
Читайте также:
 Управление по контролю за продуктами и лекарствами США (FDA) одобрило продукт XELJANZ® (тофацитиниб цитрат)
Управление по контролю за продуктами и лекарствами США (FDA) одобрило продукт XELJANZ® (тофацитиниб цитрат)28-11-2013
Компания Pfizer объявила, что Управление по контролю за продуктами и лекарствами США (FDA)...
 FDA отзывает преперат Зофран (ондансетрон) в расфасовке 32 мг
FDA отзывает преперат Зофран (ондансетрон) в расфасовке 32 мг22-10-2012
В связи с высочайшей степенью опасности развития осложнений со стороны сердца FDA 4 декабря...
 Доставку заказывали?
Доставку заказывали?24-07-2013
Порошки, таблетки, таблетки… Лекарственная идея не стоит на месте, повсевременно создаются новые,...
 Станет ли Россия независимой от импортных лекарств?
Станет ли Россия независимой от импортных лекарств?05-11-2012
Планы правительства по понижению зависимости нашей страны от импорта фармацевтических средств...
 Журнал «Новости GMP» открыл подписку на 2013 год
Журнал «Новости GMP» открыл подписку на 2013 год05-11-2013
Информационный лекарственный ресурс GMPnews.RU опубликовал пресс-релиз о том, что с 2013 года...






 Приближение ответственного события часто сопровождается проблемами со сном. Чем активнее попытки заставить себя ...
Приближение ответственного события часто сопровождается проблемами со сном. Чем активнее попытки заставить себя ...
 Когда кофе бодрит, а когда истощает. Всё о влиянии кофеина на мозг. Как он работает, где проходит грань пользы и вреда, ...
Когда кофе бодрит, а когда истощает. Всё о влиянии кофеина на мозг. Как он работает, где проходит грань пользы и вреда, ...
 Что делать, если препараты железа вызывают запор. Рассказываем про современные мягкие альтернативы и как лечить ...
Что делать, если препараты железа вызывают запор. Рассказываем про современные мягкие альтернативы и как лечить ...
 Практически каждый специалист предпочитает Стоматологические установки купить, которая бы полностью удовлетворяла ...
Практически каждый специалист предпочитает Стоматологические установки купить, которая бы полностью удовлетворяла ...